Laporan Pratikum “Menguji Daya Hantar Listrik Larutan” |
Kelompok 5
|
Elektrolit dan Non Elektrolit
|
[Tahun Ajaran 2009/2010]
|
Laboraturium Kimia SMAN
1 Trenggalek
Praktikum II Semester 2
kelas X
Tahun Ajaran 2009/2010
I.
Judul Praktikum
Judul :
“Menguji
Daya Hantar Listrik Larutan”
Praktikan : 1. Dea Novichra A.M.
2. Ferdy Arbianto
3.
Fitria Nastiti Hardyani
4. Muhibbuddin Kamal
5. Nursita Ratih
Nomor
Absen: 1. 07
2. 14
3.
15
4.
23
5.
28
Kelas : X-8
Tanggal : 19 Maret 2010
II.
Tujuan Praktikum :
F Siswa dapat mengamati gejala-gejala hantaran
listrik melalui larutan
F Siswa dapat membedakan Larutan Elektrolit dan Non
Elektrolit
F Siswa dapat membedakan larutan yang termasuk Elektrolit
Lemah dan Elektrolit Kuat
III.
Dasar Teori :
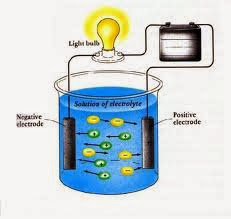
A. Gejala
hantaran Arus Listrik pada Larutan
Arus listrik timbul karena adanya aliran elektron,
yaitu suatu partikel yang bermuatan negative. Elektron – elektron dapat
mengalir melalui suatu bahan yang disebut konduktor, seperti besi dan kawat
tembaga. Gejala – gejala hantaran arus listrik pada larutan dapat anda amati
melalui percobaan uji daya listrik pada berbagai larutan. yang apabila larutan
tersebut dapat menghantarkan arus listrik akan menimbulkan gejala- gejala
sebagai berikut, yaitu Bola lampu menyala dan terdapat gelembung gas pada
larutan yang diuji coba.
B. Larutan Elektrolit dan Non
Elektrolit
Larutan merupakan fase yang setiap hari ada disekitar kita.
Suatu sistem homogen yang mengandung dua atau lebih zat yang masing-masing
komponennya tidak bisa dibedakan secara fisik disebut larutan, sedangkan suatu
sistem yang heterogen disebut campuran. Biasanya istilah larutan dianggap
sebagai cairan yang mengandung zat terlarut, misalnya padatan atau gas dengan
kata lain larutan tidak hanya terbatas pada cairan saja.
Komponen dari larutan terdiri
dari dua jenis, pelarut dan zat terlarut, yang dapat dipertukarkan tergantung
jumlahnya. Pelarut merupakan komponen yang utama yang terdapat dalam jumlah
yang banyak, sedangkan komponen minornya merupakan zat terlarut.
Larutan terbentuk melalui
pencampuran dua atau lebih zat murni yang molekulnya berinteraksi langsung
dalam keadaan tercampur. Semua gas bersifat dapat bercampur dengan sesamanya,
karena itu campuran gas adalah larutan.
Larutan Elektrolit
Berdasarkan kemampuan
menghantarkan arus listrik (didasarkan pada daya ionisasi), larutan dibagi menjadi dua, yaitu elektrolit kuat dan elektrolit lemah serta larutan non elektrolit. Larutan elektrolit adalah larutan yang
dapat menghantarkan arus listrik, sedangkan larutan non elektrolit adalah larutan yang tidak dapat
menghantarkan arus listrik. Larutan elektrolit terbentuk
dari terlarutnya senyawa elektrolit dalam pelarut air.
Pada
pengujian daya hantar listrik, larutan elektrolit menunjukkan gejala-gejala
berupa menyalanya lampu pada alat uji dan timbulnya gelembung gas dalam
larutan.
Larutan elektrolit kuat adalah larutan yang mempunyai
daya hantar arus listrik, karena zat terlarut yang berada didalam pelarut
(biasanya air), seluruhnya dapat terurai sempurna membentuk ion
positif (kation) dan ion negative (anion) dengan harga
derajat ionisasi adalah satu (α = 1). Pada pengujian daya hantar
listrik, larutan elekrolit kuat menunjukkan gejala-gejala berupa menyalanya
lampu pada alat uji dan timbulnya gelembung gas dalam larutan. Yang tergolong elektrolit kuat adalah :
Asam kuat, antara lain: HCl, HClO3, HClO4, H2SO4,
HNO3 dan lain-lain.
Basa kuat, yaitu basa-basa golongan alkali dan alkali tanah,
antara lain : NaOH, KOH, Ca(OH)2, Mg(OH)2, Ba(OH)2
dan lain-lain.
Garam-garam
yang mempunyai kelarutan tinggi, antara
lain : NaCl, KCl, KI, Al2(SO4)3 dan lain-lain.
Larutan elektrolit lemah adalah larutan yang mampu
menghantarkan arus listrik dengan daya yang lemah, dan juga
tidak terurai sempurna dalam air dengan
harga derajat ionisasi lebih dari nol tetapi kurang dari satu (0 < α <
1). Pada pengujian daya hantar arus lstrik, larutan
elektrolit lemah tidak memberikan gejala lampu menyala atau menyala tapi redup,
dan menimbulkan gelembung gas. Yang tergolong larutan elektrolit lemah adalah:
Asam lemah, antara lain: CH3COOH, HCN, H2CO3,
H2S dan lain-lain.
Basa lemah, antara lain: NH4OH, Ni(OH)2 dan
lain-lain.
Garam-garam
yang sukar larut, antara lain: AgCl, CaCrO4,
PbI2 dan lain-lain.
Larutan non-elektrolit adalah larutan yang tidak terurai
dalam air sehingga tidak dapat menghantarkan arus listrik,
hal ini disebabkan karena larutan tidak dapat menghasilkan ion-ion (tidak
meng-ion). Pada pengujian daya hantar arus lstrik, larutan
non- elektrolit tidak menimbulkan gejala-gejala seperti yang disebutkan tadi. Yang termasuk dalam larutan non elektrolit antara lain :
z Larutan urea
z Larutan sukrosa
z Larutan glukosa
z Larutan
alcohol dll.
C. Senyawa
ionik dan kovalen
Senyawa
ionic adalah senyawa yang terbentuk dari ion – ion melalui ikatan ionic. Yang
tersusun dari ion positive atau kation dan ion negative atau anion.
Senyawa
kovalen adalah senyawa yang terdiri atas atom – atom yang bukan ion yang
berikatan secara kovalen.
IV.
Alat dan Bahan :
v Alat :
a) Sumber arus DC (Adaptor)
b) Kabel
c) Gelas Kimia
d) Bola Lampu
e) Elektroda
f) Saklar
v Bahan :
a)
Larutan garam dapur (NaCl) secukupnya
b)
Larutan asam cuka (CH3COOH) secukupnya
c)
Larutan asam klorida (HCL) secukupnya
d)
Larutan natrium hidroksida (NaOH) secukupnya
e)
Larutan gula (C12H22O11) secukupnya
f)
Larutan alcohol (C2H5OH)
g)
Air sumur (H2O) secukupnya
h)
Air hujan secukupnya
i)
Air PAM
j)
Air Laut
k)
Air Sungai
V.
Gambar Alat :
a) Sumber arus DC (Adaptor)

b) Kabel

c) Gelas Kimia

d) Bola Lampu

e) Elektroda

f) Saklar

VI.
Cara Kerja :
1) Bersihkan semua peralatan yang akan digunakan dan
dikeringkan!
2) Masukkan larutan garam dapur (NaCl) secukupnya ke
dalam gelas kimia yang bersih dan kering!
3) Ujilah daya hantar listriknya dengan menggunakan
rangkaian alat penguji elektrolit dengan cara mencelupkan elektroda ke dalam
larutan!
4) Amati perubahan yang terjadi dan apakah lampu
menyala (catat dalam table pengamatan)!
5) Bersihkan dulu
elektroda dengan aquades dan keringkan!
6) Dengan cara yang sama, ujilah daya hantar larutan
yang tersedia!
VII.
Data Pengamatan :
No
|
Larutan
|
Nyala Lampu
(terang,redup,tidak menyala)
|
Gelembung Udara
(ada,tidak,banyak,sedikit)
|
1
|
Larutan garam dapur (NaCl)
|
Terang
|
Banyak
|
2
|
Larutan asam cuka (CH3COOH)
|
Tidak Menyala
|
Sedikit
|
3
|
Larutan asam klorida (HCL)
|
Terang
|
Banyak
|
4
|
Larutan natrium hidroksida (NaOH)
|
Terang
|
Banyak
|
5
|
Larutan gula (C12H22O11)
|
Tidak Menyala
|
Tidak ada
|
6
|
Air Sumur/Kran (H2O)
|
Tidak Menyala
|
Sedikit
|
7
|
Air Hujan secukupnya
|
Tidak Menyala
|
|
8
|
Air PAM secukupnya
|
Tidak Menyala
|
Tidak ada
|
9
|
Air Laut secukupnya
|
Terang
|
Banyak
|
10
|
Air Sungai secukupnya
|
Tidak Menyala
|
Sedikit
|
VIII.
Pembahasan
Dalam
praktikum menguji larutan daya hantar listrik yang telah dilakukan hasilnya
menunjukan bahwa larutan garam dapur (NaCl),
larutan asam klorida (HCl) dan
larutan natrium hidroksida (NaOH)
serta air laut menghasilkan gelembung yang banyak dan nyala lampu yang terang,
sehingga termasuk dalam larutan elektrolit kuat. Dalam praktikum ini hasil
tersebut sesuai dengan teori yang telah dipelajari dalam materi sebelumnya.
Sedangkan dalam larutam asam cuka (CH3COOH),
air sumur (H2O), air
hujan, air sungai menghasilkan gelembung sedikit dan nyala lampu yang dihasilkan
redup dan ada juga yang tidak menyala sehingga digolongkan dalam elektrolit
lemah, hal itu juga sesuai dengan teori. Dalam praktikum ini juga ada yang
tidak menghasilkan gelembung serta lampu tidak menyala yaitu larutan gula (C12H22O11)
dan air PAM
Dalam
uji praktikun ini terdapat terdapat hasil yang tidak sesuai dengan teori,
tepatnya pada percobaan Air PAM seharusnya Air PAM tergolong dalam larutan
Elektrolit Lemah namun dari hasil percobaan ini tidak menghasilkan gelembung
dan lampu tidak menyala (Non Elektrolit) hal tersebut mungkin terjadi karena
adanya kesalahan sistematis dan acak. Yaitu kesalahan yang disebabkan karena
alat yang digunakan dalam praktikun kurang mendukung yaitu olektroda yang
digunakan ataupun yang lain dan juga bahan yang diambil sudah terkontaminasi.
Dan kesalahan yang disebabkan fluktuasi tegangan listrik, karena dalam
praktikum ini kita menggunakan arus listrik, sehingga hasil dari praktikum
dengan bahan Air PAM tidak sesuai dengan teori.
IX.
Jawaban pertanyaan
1)
Gejala apakah yang menandai hantaran listrik melalui larutan?
Ø Adanya gelembung udara pada anoda & katoda dan
nyala lampu yang dihasilkan (terang, redup, tidak menyala)
2)
Kelompokkan bahan-bahan yang diuji ke dalam larutan elektrolit dan non
elektrolit!
Ø Larutan Elektrolit :
| Larutan garam dapur (NaCl)
| Larutan asam cuka (CH3COOH)
| Larutan asam klorida (HCL)
| Larutan natrium hidroksida (NaOH)
| Larutan alcohol (C2H5OH)
| Air sumur (H2O)
| Air Hujan
| Air Laut
| Air Sungai
Ø Larutan Non Elektrolit :
{ Larutan gula (C12H22O11)
{ Air PAM
3)
Kelompokkan bahan-bahan yang diuji ke dalam larutan elektrolit kuat
(lampu menyala) dan elektrolit lemah (lampu tidak menyala, tetapi menghasilkan
sedikit gelembung)!
Ø
|
Elektrolit Kuat :
Ì Larutan garam dapur (NaCl)
Ì Larutan asam klorida (HCl)
Ø Elektrolit Lemah :
Ë Larutan asam cuka (CH3COOH)
Ë Air Sumur/Kran (H2O)
Ë Air Hujan
Ë Air Sungai
4)
Di antara larutan elektrolit itu, larutan manakah yang zat terlarutnya
tergolong:
a. Senyawa ion :
Larutan NaCl dan Larutan NaOH
b. Senayawa kovalen :
Larutan HCl, Larutan CH3COOH, Larutan H2O
5)
Apakah penyebab larutan elektrolit dapat menghantarkan arus listrik?
Ø Pada larutan elektrolit zat terlarut dalam larutan dapat
terurai menjadi ion-ion yang bergerak bebas, sehingga Larutan Elektrolite dapat
menghantarkan arus listrik
6)
Tuliskan reaksi ionisasi dari larutan :
a) NaCl :
Na+ + Cl-
b) CH3COOH :
H+ + CH3COO-
c) HCL :
H+ + Cl-
d) NaOH :
Na+ + OH-
X.
Kesimpulan :
Dari percobaan di atas dapat disimpulkan bahwa,
untuk mengetahui suatu zat tergolong Elektrolit Kuat, Elektrolit Lemah, Non
Elektrolit sebagai berikut :
Untuk mengetahui apakah suatu larutan tergolong Elektrolit
Kuat, Elektrolit Lemah, Non Elektrolit dapat dilihat dari nyala lampu dan
gelembung yang dihasilkan dalam percobaan ini.
Larutan Elektrolit Kuat ditandai dengan nyala lampu
yang terang dan gelembung udara yang dihasilkan banyak.
Contoh: Larutan NaCl, Larutan HCl, Lautan NaOH
Larutan Elektrolit Lemah menghasilkan nyala lampu
yang redup/tidak menyala dan gelembung yang dihasilkan sedikit.
Contoh : Larutan CH3COOH, H2O, Air
Hujan, Air Sungai
Larutan Non Elektrolit tidak menghasilkan nyala
lampu dan tidak menghasilkan gelembung.
Contoh : Larutan gula (C12H22O11)






0 comments:
Post a Comment